使用 Advion Interchim Scientific 进行寡核苷酸定性分析® 高效液相色谱-紫外/质谱系统

仪表
质谱: 前任expression® 紧凑型质谱仪(CMS)
HPLC:前卫®
介绍
寡核苷酸由于其独特的优势而在生物制药领域受到广泛关注。
调节基因或蛋白质表达的能力。 随着几种基于寡核苷酸的药物获得批准或进入临床试验,他们的临床成功是显而易见的。[1] 这些药物包括反义寡核苷酸、小干扰 RNA (siRNA) 疗法和基于 mRNA 的疫苗,新冠肺炎 (COVID-19) 疫苗的成功开发就是例证。 这些成就激发了人们对寡核苷酸研究和开发的进一步兴趣和投资。
固相合成是生产寡核苷酸序列的常用方法。 原材料通常通过各种技术进行纯化,例如脱盐、超滤、固相萃取 (SPE)、高效液相色谱 (HPLC) 或制备型液相色谱 (prepLC),具体取决于所需的纯度水平。 离子对 HPLC 或 prepLC 方法通常是首选,因为与其他技术相比,它们可提供更高的纯度。
本应用说明旨在演示多种寡核苷酸样品的 HPLC/UV 分析,并利用 HPLC/CMS 分析确定其分子量。
付款方式
HPLC-UV/CMS系统
借助四元泵和色谱柱选择阀,在不同缓冲液和色谱柱之间进行各种分析的切换过程变得非常简单,无需手动操作
拆下色谱柱并更换溶剂。 这种自动化极大地提高了分析过程的效率和便利性。

Oligo(dT) 12-18 引物
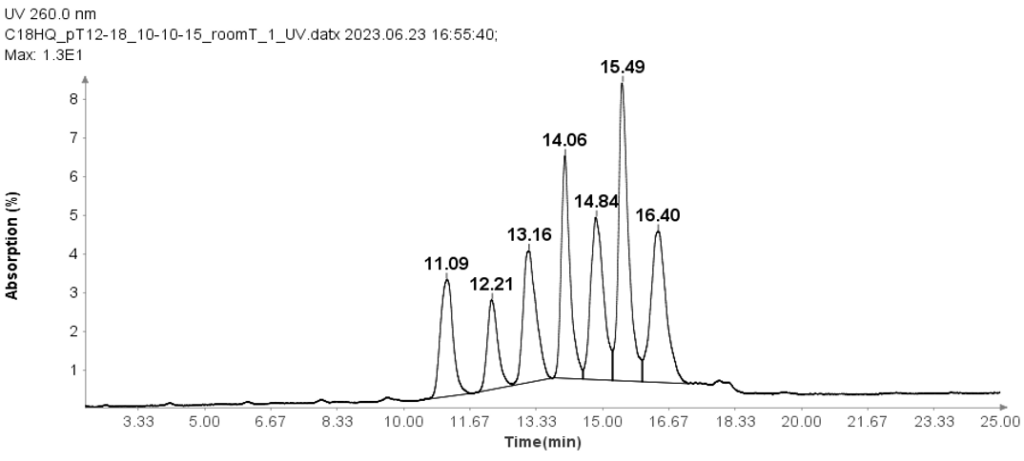
使用 Oligo(dT) 12-18 引物(Thermos Fisher Scientific,MA)检查寡核苷酸分析的 HPLC 方法。
这些 Oligo(dT) 12-18 引物的分离是使用离子对反相 HPLC 方法和 Interchim Uptisphere Strategy 5 μm C18HQ 色谱柱 250 x 4.6 mm 进行的。 所有分析均注入 10 μL 等分试样,柱温保持在 30°C。 流动相 A 的组成为 100 mM TEAA 水溶液,而流动相 B 为乙腈。 流速为1ml/min。
HPLC 分析进行如下:注入样品后,将流动相 B 设置为 10%,持续 1 分钟。 然后在 15 分钟内线性增加到 24%。 在 25.1 分钟时,它增加到 95%,并在此水平保持 2.4 分钟以清洗色谱柱。 随后,在 27.6 分钟时,其减少至 10%,并维持 2.4 分钟以进行柱平衡。
图 1 说明 HPLC 方法有效分离了 12 个 Oligo(dT) 18 至 XNUMX 引物。
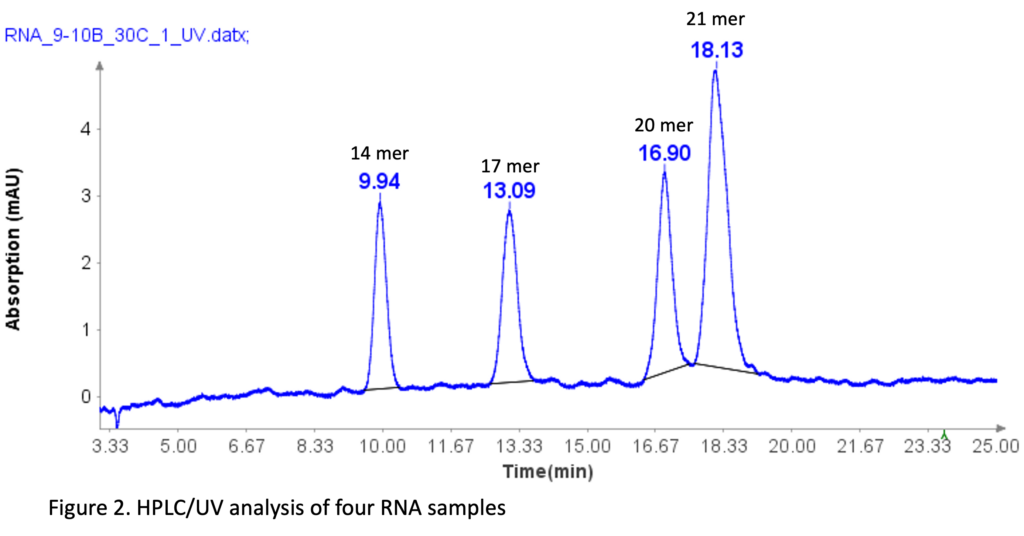
含 4 种成分的 RNA 标准品
RNA 寡核苷酸混合物(Aglient Technologies,CA)在 HPLC 分析之前用去离子水稀释 10 倍来制备。 四种RNA标准品的序列如下:14 mer(CACUGAAUACCAAU)、17 mer(UCACACUGAAUACCAAU)、20 mer(UCAUCACACUGAAUACCAAU)和21 mer(GUCUCAUCACACUGAAUACCAAU)。
这些 RNA 样品的分离使用与oligo(dT)12-18 引物类似的 HPLC 方法进行,但略有修改。
HPLC 分析进行如下:注入样品后,将流动相 B 设置为 9%,持续 1 分钟。 然后在 10 分钟内线性增加到 24%。 在 25.1 分钟时,它增加到 95%,并在此水平保持 2.4 分钟以清洗色谱柱。 随后,在 27.6 分钟时,其减少至 9%,并维持 2.4 分钟以进行柱平衡。
图 2 说明 HPLC 方法可以有效分离四种 RNA 样品,即使 1 聚体和 20 聚体 RNA 样品之间存在 21 聚体差异。 20 聚体和 21 聚体的基线分离对于分析合成寡核苷酸至关重要,因为合成过程中的大多数杂质通常为 N=1 聚体或 N+1 聚体。[2]
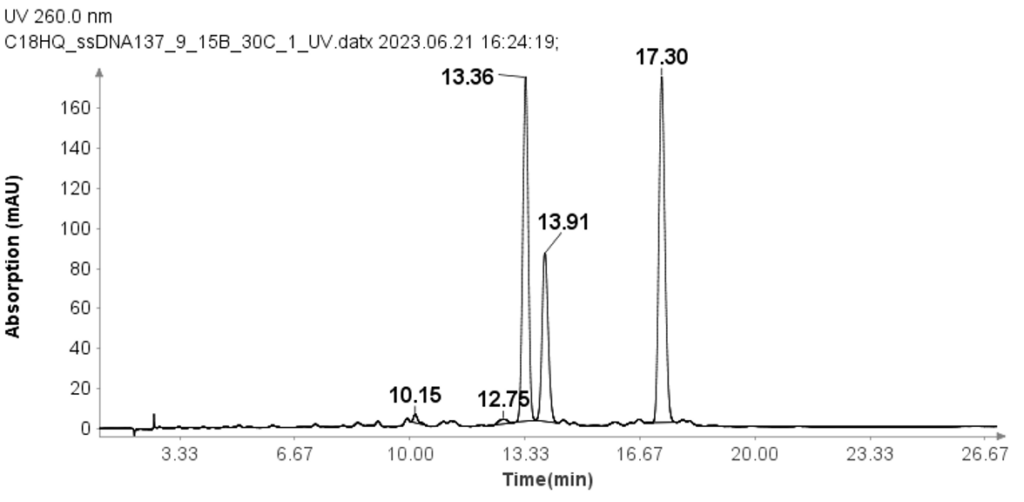
单链DNA样本
还使用用于 RNA 样品的改进 HPLC 方法测试了具有 17 mer (GTCAGCAAGGACATCGT)、18 mer(CATTTGAGTAGCCAACGC) 和 19 mer (GGACACTTTCATGCGAGTT) 的三个单链 DNA 样品 (ssDNA)。
每个 ssDNA 的浓度为 30 μM,将 10 μL 等份上样到柱上进行分析。 使用以下梯度进行 HPLC 分析:样品注射后,流动相 B (MPB) 设置为 9%,持续 1 分钟,然后在 15 分钟内线性增加至 24%。 在 25.1 分钟时,它增加到 95%,并在此水平保持 2.4 分钟以清洗色谱柱。 27.6 分钟时,MPB 降至 9%,并维持该水平 2.4 分钟以进行柱平衡。 分析的流速设置为1.5ml/min。 尽管与 RNA 样品相比,每分钟溶剂 B 的变化更大,但图 3 表明该方法以良好的基线分辨率有效分离了三个 ssDNA 样品。
单链 DNA 样品的纯度分析
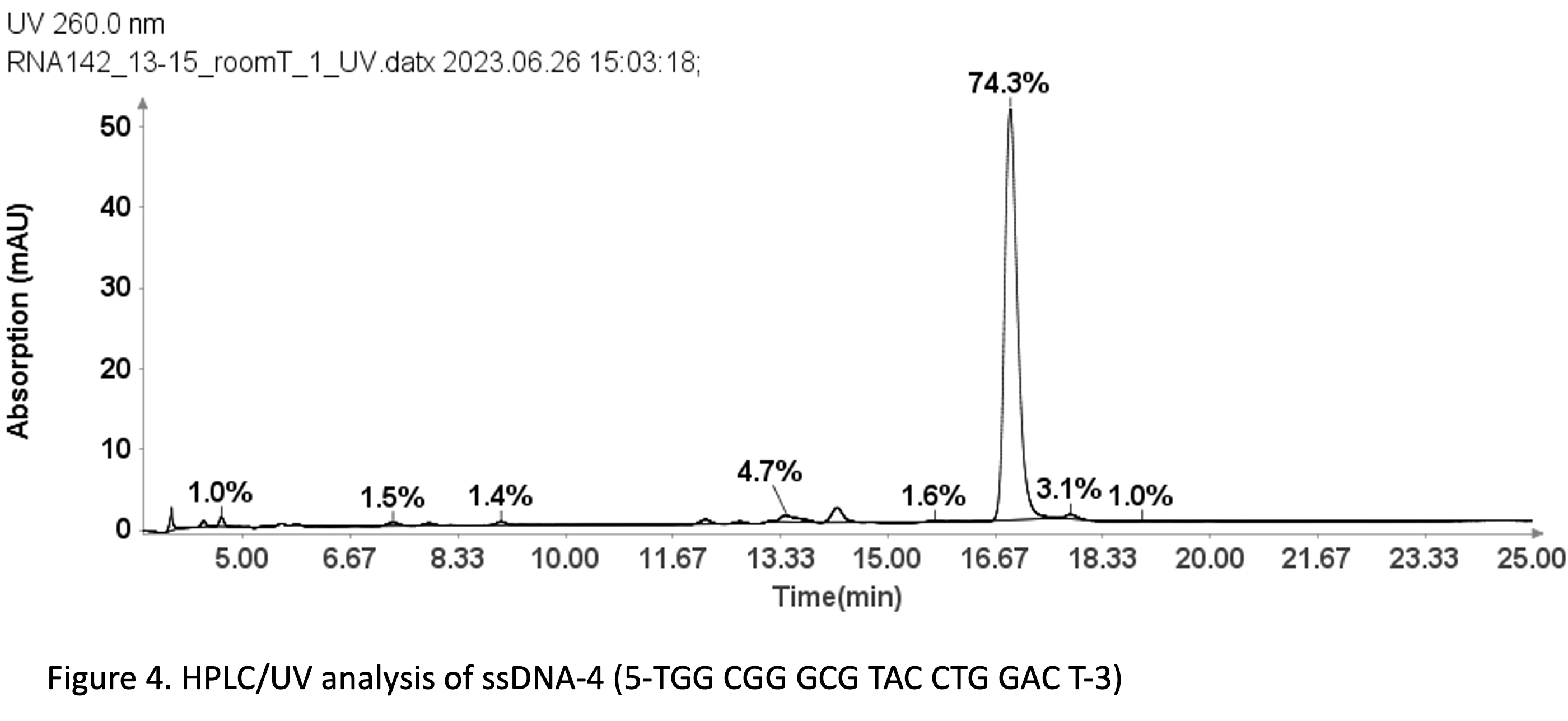
采用与图 3 所示的 ssDNA 样品相同的方法,也可用于 ssDNA 样品的纯度分析:19 mer (5'-TGGCGGGCGTACCTGGACT-3')。
图 4 显示,使用 Advion Data Express 软件测定的 19 聚体 ssDNA 4 在 74.3 nm 处的 UV 纯度为 260%。
F.5 纯度分析中使用的 ssDNA 样品的 MS 分析
使用 Advion AVANT 进行寡核苷酸的 HPLC/MS 分析® 与 Advion Ex 结合的 HPLC 系统expression® CMS-L。 对于 MS 分析,使用尺寸为 2.6 x 18 mm 的 Interchim Uptisphere Strategy 50 μm C2.1-HQ 色谱柱,流速为 0.2 ml/min。 柱温设定为55℃。
与使用 TEAA 进行寡核苷酸质量分析相比,结合 TEA 和 HFIP 的离子对试剂可显着提高性能。 因此,本应用笔记将重点介绍如何使用 TEA 和 HFIP 离子对试剂对寡核苷酸进行 HPLC/MS 分析。
流动相由 15 mM TEA 和 10 mM HFIP 水溶液(作为流动相 A)和甲醇(作为流动相 B)组成。总 HPLC 运行时间为 25 分钟,从 5% 溶剂 B 开始 1 分钟。
然后 B 的百分比在 6 分钟内增加至 14%,随后在 95 分钟增加至 15.1%,并保持 2.9 分钟以洗脱感兴趣的化合物。 随后,将 % B 降低至 5%,并在此水平保持 6.9 分钟,以便在下一次分析之前平衡色谱柱。
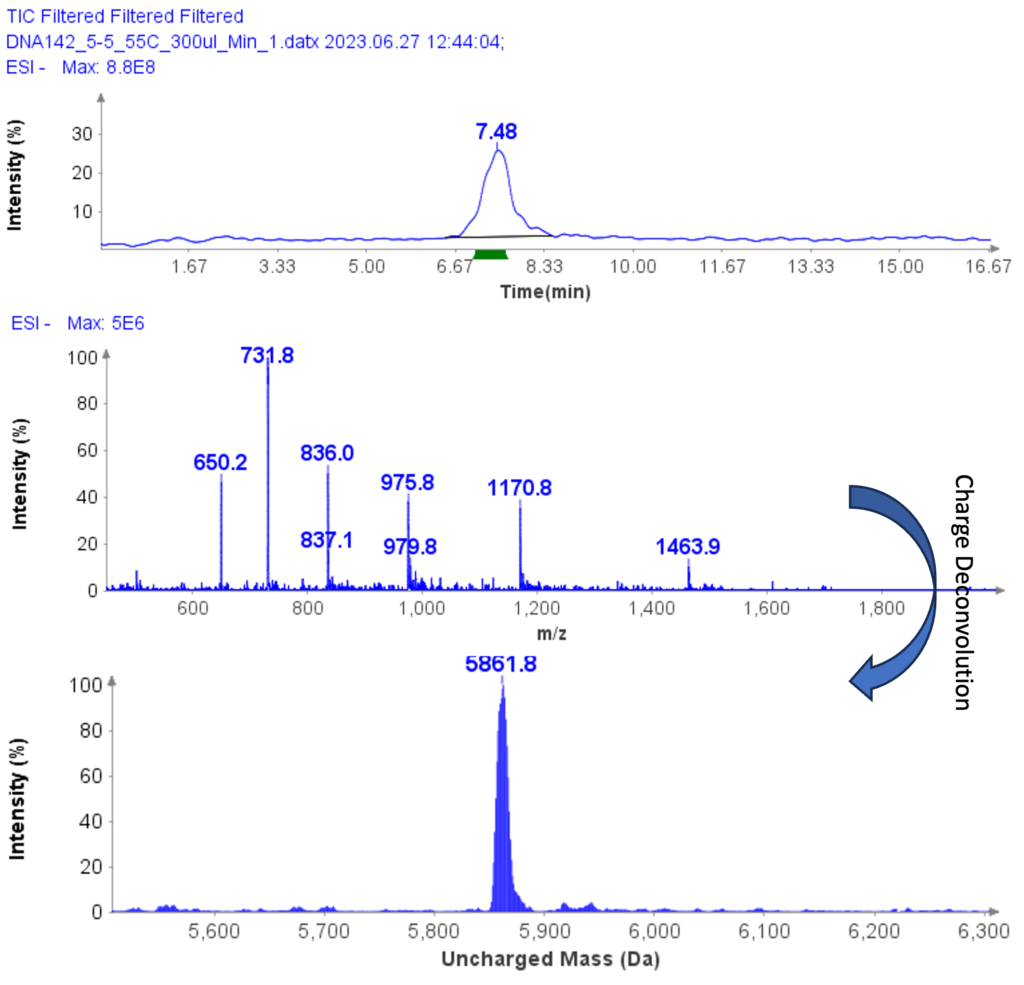
MS 分析在负 ESI 模式下进行,MS 扫描范围设置为 500 至 2000 Da。 图 5b 显示了 ssDNA-4 的 MS 谱图,显示带电包络,峰位于 m/z 1463.9 (4-)、1170.8 (5-)、(975.8 (6-)、936.0 (7-)、731.8 (8-) ) 和 650.2 (9-)。通过 Data Express 中的电荷解卷积,确定 ssDNA 样品的不带电质量为 5861.8 Da,这与理论值 5860.8 Da 非常吻合。
另一个示例样品的 MS 分析
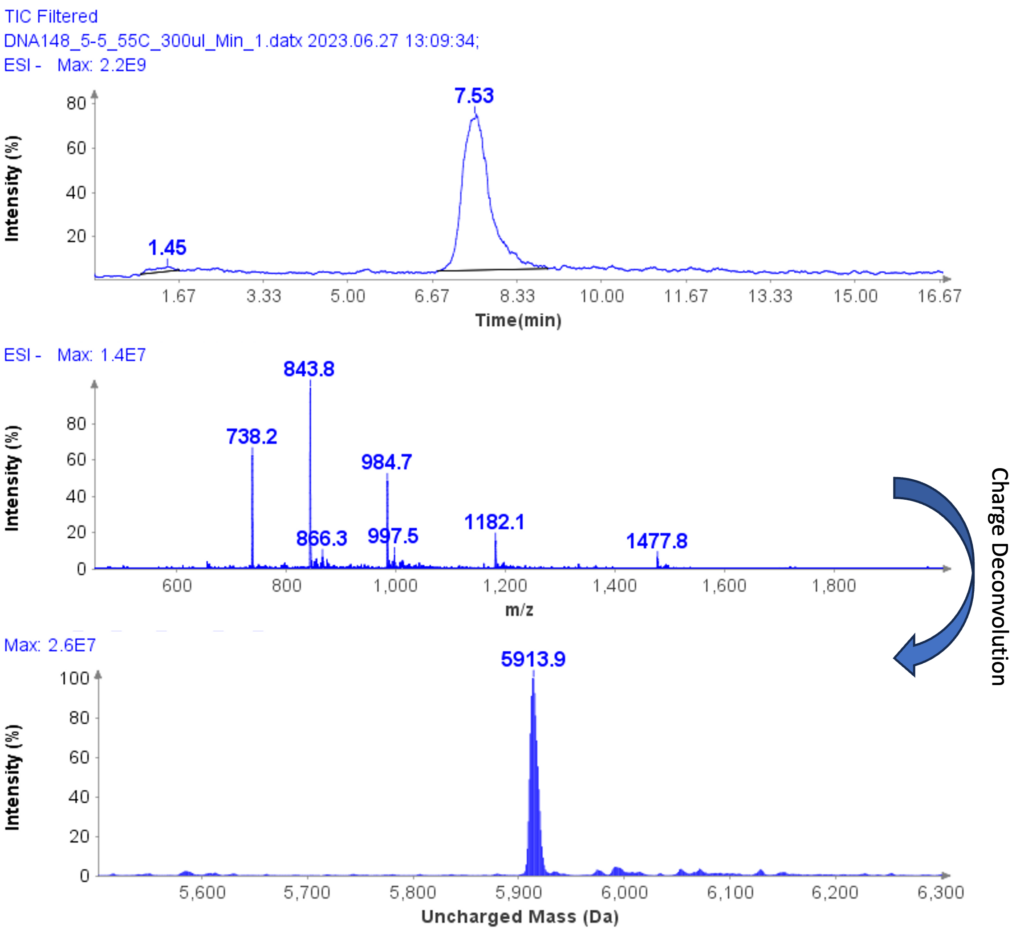
ssDNA-5 (5'-GGG-TGG-CAT-TATGCT-GAG-T-3') 的 MS 谱如图 6 所示,显示带电包络,峰位于 m/z 1477.8(4-)、1182.1( 5-)、984.7(6-)、843.8(7-) 和 738.2(8-)。 通过电荷解卷积,确定 ssDNA-5 的不带电质量为 5913.9,这与理论值 5914.9 非常一致。
结语
事实证明,使用 5 μm 粒径的 C18HQ 色谱柱与 TEAA(醋酸三乙铵)离子对试剂结合是寡核苷酸 HPLC 分析的合适解决方案。
对于寡核苷酸的 MS 分析,可以使用相同的 C18HQ 色谱柱,将 HFIP(六氟异丙醇)和 TEA(三乙胺)作为离子对试剂与 AVANT 结合使用® HPLC-UV/CMS 系统。 该方法已被证明可以对寡核苷酸进行额外的精确质量测量。
总体而言,将 Interchim C18HQ 色谱柱和适当的离子对试剂与 AVANT 结合使用® HPLC-UV和-CMS系统可以为寡核苷酸的纯度分析和表征提供可靠的解决方案。
案例
[1]Roberts, TC、Langer, R. 和 Wood, MJA 寡核苷酸药物输送方面的进展。 自然修订药物发现 2020, 19, 673–694
[2]玛蒂娜·C.等人寡核苷酸:合成、表征和纯化的当前趋势和创新应用,Biotechnology J. 2020, 1900226
